KCSG 소식

- 알림
- KCSG 소식
| 주요 연구성과 | 간행물 | 미디어 | 연구회동정 | KCSG 인사이트 | 뉴스레터 |
[KCSG ST18-03] Br J Cancer. 2025 May 21.
- 작성자 관리자
- 등록일 2025-12-11
- 조회수 14
▶ KCSG ST18-03
Multicenter phase lb/ll study of second-line durvalumab and tremelimumab in combination with paclitaxel in patients with biomarker-selected metastatic gastric cancer
제1저자 : 김형돈(서울아산병원)
Q. 연구의 배경은?
위암은 전 세계적으로 사망률이 네 번째로 높은 암종이며, 치료 성과 개선이 시급합니다. 지난 10년간 면역관문억제제(ICI)를 포함한 전신 화학요법에서 상당한 발전이 있었고, 특히 1차 치료에서 ICI 병용 요법이 생존 혜택을 확인하여 표준 치료로 승인되었습니다. 그러나 1차 치료 실패 후 표준인 라무시루맙과 파클리탁셀 병용 요법의 효과는 반응률 30% 미만, 무진행 생존 기간(PFS) 중앙값 약 4개월로 여전히 제한적입니다. 이에 따라 더 나은 2차 치료법이 절실히 요구되고 있습니다. ICI는 위암에서 생존 혜택을 보였지만, 많은 환자들이 이에 반응하지 않거나 면역 관련 부작용을 겪습니다. 따라서 치료 반응을 예측할 수 있는 바이오마커를 활용하여 환자를 선별하는 것이 더욱 효과적인 치료 접근법으로 대두되었습니다. 본 연구는 파클리탁셀이 면역억제 세포를 줄여 항종양 면역 반응을 강화할 수 있다는 전임상 연구를 바탕으로, 이중 면역관문억제(더발루맙 + 트레멜리무맙)와 파클리탁셀을 병용하는 2차 치료법을 모색하기 위해 설계되었습니다.
Q. 연구의 목적은?
이 단일군, 다기관, 공개 라벨 임상 1b/2상 연구는 1차 화학요법에 실패한 전이성 위암 환자 중 잠재적인 면역관문억제제 반응 예측 바이오마커에 따라 선별된 환자를 대상으로 더발루맙 (항-PD-L1), 트레멜리무맙 (항-CTLA-4) 및 파클리탁셀 삼제 병용 요법의 유효성과 안전성을 평가하는 것을 목표로 했습니다. 1b상에서는 용량 제한 독성 (DLT)을 평가하여 권장 2상 용량(RP2D)을 결정하는 것이 주된 목적이었습니다. 2상 연구의 주된 목적은 임상적으로 중요한 최소 목표인 33%를 넘어선 객관적 반응률( ORR)을 달성하는지 확인하는 것이었습니다. 부수적으로는 무진행 생존 기간 (PFS), 전체 생존 기간 (OS), 반응 지속 기간 (DOR)을 포함한 효능과 잠재적 바이오마커와의 상관관계를 평가하고자 했습니다.
Q. 연구 방법?
본 연구는 전이성 위암 환자를 대상으로 하는 단일군, 다기관, 공개 라벨 임상 1b/2상 시험이었습니다. 1b상에서는 표준 3+3 용량 증량 방식을 사용하여 더발루맙 1500mg(4주마다 13주기), 트레멜리무맙 75mg(4주마다 4주기)과 함께 파클리탁셀을 60 mg/m2 (용량 수준 1) 또는 80 mg/m2 (용량 수준 2)로 4주 주기 중 1일, 8일, 15일에 투여했습니다. 1b상에서 용량 제한 독성(DLT)을 평가한 후, 용량 수준 1이 권장 2상 용량 (RP2D)으로 결정되었습니다. 2상 환자는 이 RP2D로 치료받았으며, 포함 기준은 CD274 증폭, MSI-high/dMMR, EBV 양성, 높은 TMB (≥5/Mb) 중 하나 이상의 예측 바이오마커를 보유해야 했습니다. 총 48명의 환자가 2상 연구에 등록되었으며, 치료는 질병 진행이나 허용할 수 없는 독성이 발생할 때까지 지속되었습니다. 종양 반응은 RECIST v1.1에 따라 8주마다 평가되었고, 안전성은 NCI Common Toxicity Criteria v4.03에 따라 매 주기 전에 평가되었습니다.
Q. 연구 결과?
이 연구에서 바이오마커로 선별된 전이성 위암 환자들에게 더발루맙-트레멜리무맙-파클리탁셀 병용 요법은 전반적으로 내약성이 양호하고 유효했습니다. 2상 연구에서 객관적 반응률(ORR)은 52.1%로 나타나, 사전 설정된 주 평가 변수 목표인 33%를 충족했습니다. 전체 환자군의 중앙값 무진행 생존 기간 (PFS)은 5.3개월 (95% CI, 3.5-7.2), 전체 생존 기간( OS)은 13.1개월 (95% CI, 10.1-20.9)로 나타났습니다. 반응을 보인 환자들의 반응 지속 기간( DOR) 중앙값은 11.0개월이었습니다. 안전성 측면에서는 어떤 등급이든 가장 흔한 이상 반응( AE)은 빈혈(41.7%), 감각 신경병증(35.4%), 탈모(29.2%)였으며, 3-4등급 AE 중 가장 흔한 것은 호중구 감소증(10.4%)이었습니다. 연구에서 5등급 AE (사망)는 관찰되지 않았습니다.
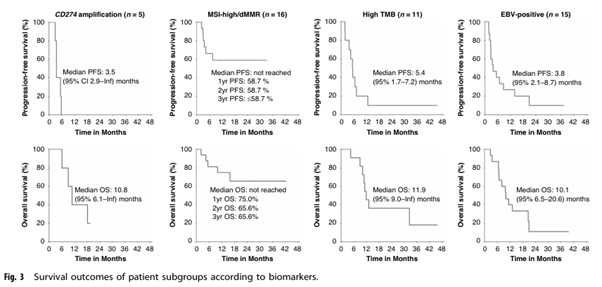 |
특히, MSI-high/dMMR 아형 환자(n=16)는 ORR 62.5%로 가장 유리한 결과를 보였으며, 3년 PFS 및 OS율이 각각 58.7% 및 65.6%로 표준 치료 대비 현저히 우수함을 시사했습니다. 이는 위암에서 ICI 기반 치료에 대한 바이오마커 기반 접근법의 중요성을 강조하는 결과입니다.
Q. 마지막으로 하고 싶은 말은?
본 연구는 KCSG의 도움을 통해 진행된 다기관 연구로, 여러 기관의 협업을 통해서 수행될 수 있었습니다. 앞으로도 양질의 다기관 연구가 KCSG의 도움을 받아 수행되길 기대합니다.
-
다음 글
-
이전 글
 회원검색
회원검색 통합검색
통합검색 교육신청
교육신청 연구검색
연구검색 데이터
데이터 TOP
TOP


